2021 年,日本一项针对 2 万多名大学生( 17,573 名男性和 8860 名女性)饮食习惯和体重变化的研究发现:
- 不吃晚餐被确定为体重增加(≥10%)的重要预测因子;
- 不吃晚餐,超重 / 肥胖(体重指数 BMI ≥ 25 kg/m2)的风险显著上升。

不吃晚饭为什么对减肥无用,甚至可能导致增肥,除了和我们最常说的热量差等有关,其实还和“肠道菌群”的关系非常密切。
有些人,胡吃海喝也不容易发胖;而有的人,严防死守却“喝水都长肉“。为什么同样穿肠过,有的人就胖了,有的人却不容易胖呢?
我们吃的食物在进入肠道后,经过蠕动,变成食糜,经过酶的分解,小肠绒毛的吸收,食物中的糖类、脂类、蛋白质、维生素、无机盐、水都被顺利吸收。
但是不同的人,肠道内有不同的微环境,尤其是微环境内的微生物种类和群落有很大差异,就造成了不同的吸收结果,最终引发人的形态差异。更重要的是,这些肠道内的微环境,还会多方面影响我们的健康,如内分泌系统、神经系统、心血管系统。

肠道里的微生物是怎样影响我们的内环境呢?微生物 - 肠 - 脑轴
肠道内的微生物会将代谢物和调节因子分泌到肠道内,随后进入血液循环。这些肠道微生物的“产物”会在大脑和胃肠道之间建立一个桥梁,负责向大脑传递肠道的“信号”,也会接收大脑传达给肠道的“指令”,也就是:胃肠道微生物在大脑和肠道之间建立一个双向的信号传输通道。
我们将这些微生物的“产物”在大脑和肠道之间的交流称为“ gut-brain axis (GBA) ”,也就是脑 - 肠 - 轴,还有的人将其更具体地称为“microbiota–gut–brain axis (MGBA)”,即生物群 - 肠 - 脑轴。
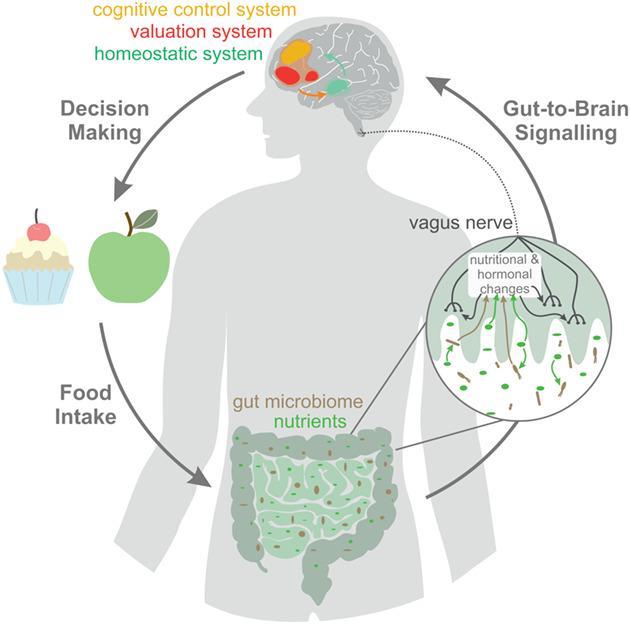
肠道微生物群的“产物”就是它们发挥生理作用的武器,这些代谢物中不乏调节肥胖的有机分子,包括链脂肪酸 (SCFA)、胆汁酸 (BA) 和 5- 羟色胺 (5-HT) 。这些产物可以通过免疫系统、血液循环和神经系统将它们想要传递的”信息“送至中枢神经系统,随后经过大脑这个“控制塔”,再将反馈信息传出到各个靶器官,比如我们的脂肪,以此实现调节体内平衡。
肠道菌群是怎样通过菌群 - 肠 - 脑轴调节肥胖的呢?
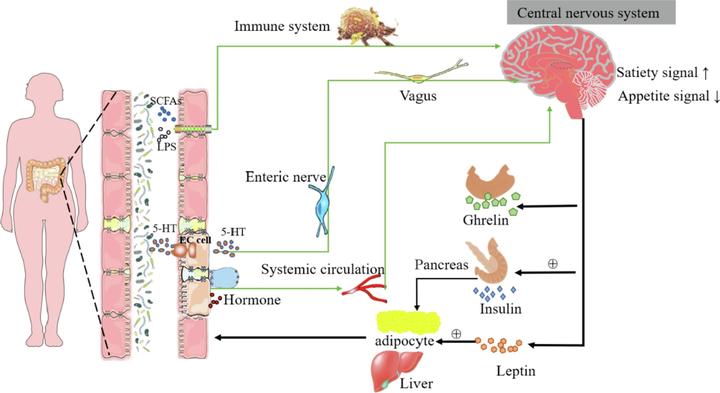
这个过程有些复杂,因为微小的肠道微生物想要调动大脑进行指令传达,是需要“翻山越岭”来搞定的。举个例子,肠道微生物群通过代谢产物,如短链脂肪酸、胆汁酸和 5-HT,来反馈出一种饱腹感,以此控制我们的食欲。
如果一个人最近得了胃肠炎或者肠道菌群紊乱,那么肠道内产生有益代谢产物的细菌可能受到影响,分泌的代谢产物减少,一个人进食后很难感受到进食的快乐或者食欲很差。
如果一个人最近焦虑、抑郁或者情绪低落,也会反馈到肠道,导致食欲减退,或者进食后饱腹感差,还有一些人会出现消化不良的问题。
肠道是怎样“翻山越岭”对话大脑的?内分泌系统
我们的肠腔是一个怎样的器官? 别看负责消化食物的小肠是一个蜗居在腹腔内的器官,其实它的全长可达 4-6 米,而小肠上皮绒毛细胞铺展开,可能有一个篮球场的面积!我们每次的食物在小肠内研磨、混合、搅拌,同时还有胰酶、胆汁一起进行化学消化,在逐渐蠕动通过小肠的过程里,营养物质被这个面积巨大的器官仔细吸收。
在肠腔内,分布着数千个专门的内胚层衍生上皮细胞,比如肠内分泌细胞 (EECs),这些细胞在控制代谢物的分泌和运动、调节食物的消化和代谢等方面发挥着重要作用。最近的研究表明, EECs 传递感觉是通过作用轴突和神经元取得联系,也就是说我们的肠道内有传递感觉的系统。通过这个系统,EECs 可以与支配胃肠道的神经元进行交流,以启动适当的功能反应。
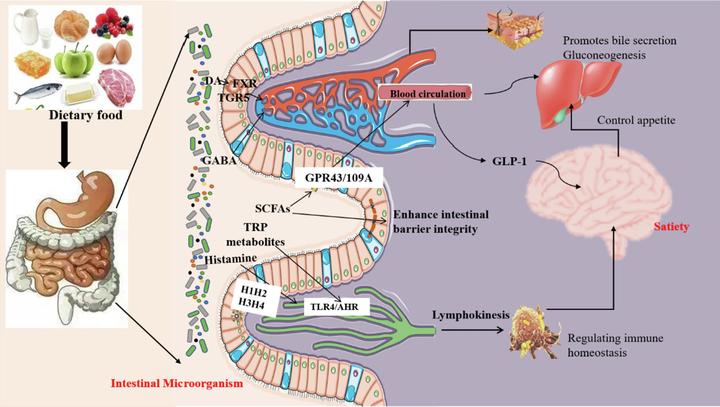
此外,有研究显示,胰高血糖素样肽 1 (GLP-1) 和肽 YY (PYY) 主要由 EECs 释放,其中 PYY 在我们进食后,在回肠和结肠里释放。GLP-1 和 PYY 不仅可以直接激活中枢神经系统(CNS)的相应神经元,还可以通过激活迷走神经作用于中枢神经系统。 通过这些内分泌细胞的“信息作战”,肠道将信息顺利传达给神经系统。
我们知道,5- 羟色胺( 5-HT)是一种重要的神经递质,在调节情绪、食欲和胃肠道运动方面发挥作用, 5-HT 正是由肠道内嗜铬细胞分泌的。 肠道微生物可以调节 5-HT 的释放和产生:当摄入膳食蛋白质或肽时,肠道微生物群会利用色氨酸作为前体来刺激嗜铬细胞分泌并合成 5-HT,这些分泌产物会触发其他激素的分泌,如乙酰胆碱、腺苷酸环化酶激活肽。有一种肿瘤就是“嗜铬细胞瘤”,属于内分泌系统的肿瘤。
神经系统
我们腹泻、肠套叠或者有较大的粪块堵塞肠道的时候,能明显感受到腹部疼痛,这是因为我们的肠道内有数以亿计的神经元,传递了肠道的“情绪”。 一个在生长阶段不断补充食物来源,增加食物种类的人,和一个一直食用无菌、单一食物的人对比,前者更容易获得一个“成熟的肠道”。这就归功于肠道的神经系统得到持续的刺激,逐渐成长起来,其中有重要作用的就是迷走神经。
迷走神经可以被多种肠道微生物群衍生分子激活,例如脂多糖 (LPS)、吲哚和 链脂肪酸 。这些分子可以刺激神经系统,督促进食或者产生进食的满足感;但是 迷走神经受损以后,这种传递信息就减弱,进食就会减少,比如用口服丁酸盐的小鼠研究消化道迷走神经的作用,就发现在丁酸盐给药后,小鼠进食减少;彻底切断迷走神经以后,小鼠此前的进食抑制会得到明显改善。
这可能给我们一个启发:厌食症有可能是因为肠道内神经系统受到抑制,导致饥饿感较少,出现进食障碍。 有些人吃不胖,可能也是肠道迷走神经比较“迟钝”或者密度较低,不能将督促进食的信号传递给大脑,导致这些人进食频率下降。
免疫系统
一般来说,药物想要通过循环进入大脑是比较难的,因为有一个“血脑屏障”。但是,肠道微生物很聪明,想办法绕过这个屏障,这个方法就是找一个“中介”。
担当肠道微生物和大脑信息传递的“中介”就是免疫系统。
肠道微生物能够控制中枢神经系统免疫细胞的功能,特别是小胶质细胞的成熟、调节功能,来实现对中枢神经系统的信息反馈。肠道菌群通过调节 Toll 样受体 (TLR)、核因子 -κB (NF-κB)、促炎细胞因子和趋化因子来调节肠腔内的免疫通路,最终实现和大脑的“对话”。
- 碳水化合物、多糖、纤维素:肠道微生物发酵后产生短链脂肪酸,可以帮助肠粘膜抗炎;
- 高脂饮食:肠道微生物发酵后产生促炎产物,导致肠腔内菌群失调和炎性水平增加,脂代谢能力下降,从而诱发肠上皮损伤。
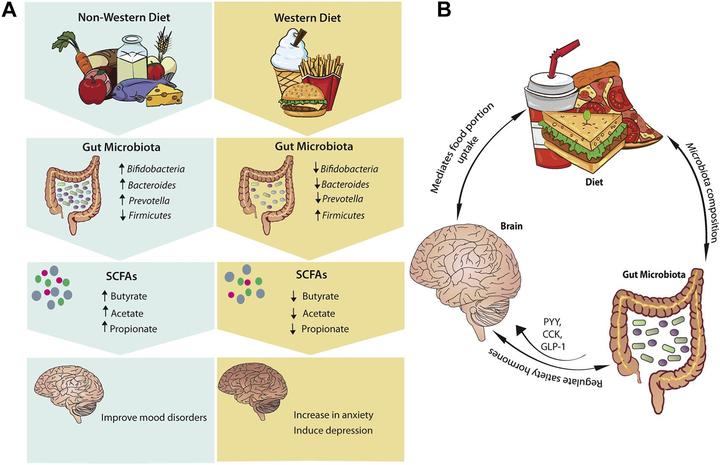
肠道微生物及代谢物在调节体内微环境中有独特作用,肠道通过多种小心思和大脑对话,传递自己的情绪和需求,这些代谢产物和参与调节的通路,在整个机体内环境的稳态中发挥重要作用。一些代谢产物可以通过作用中枢神经系统,抑制食欲,调节脂肪组织代谢,降低血糖;而一些代谢产物会引发炎症,导致内环境稳态的改变,最终诱发代谢性和免疫性疾病。
参照文献:
- Yamamoto R, Tomi R, Shinzawa M, Yoshimura R, Ozaki S, Nakanishi K, Ide S, Nagatomo I, Nishida M, Yamauchi-Takihara K, Kudo T, Moriyama T. Associations of Skipping Breakfast, Lunch, and Dinner with Weight Gain and Overweight/Obesity in University Students: A Retrospective Cohort Study. Nutrients. 2021 Jan 19;13(1):271.
- Sandhu K V , Sherwin E , Schellekens H , et al. Feeding the microbiota-gut-brain axis: diet, microbiome, and neuropsychiatry[J]. Translational Research, 2017.
- Stanton, Catherine, Shanahan, et al. Feeding the microbiota: transducer of nutrient signals for the host[J]. Gut: Journal of the British Society of Gastroenterology, 2017, 66(9):1709-1717.
- Cepeda, M Soledad, Katz,et al. Microbiome-Gut-Brain Axis: Probiotics and Their Association With Depression.
- Kim Y K , Shin C . The Microbiota-Gut-Brain Axis in Neuropsychiatric Disorders: Pathophysiological Mechanisms and Novel Treatments[J]. Current Neuropharmacology, 2017, 15(5).
- Ezra-Nevo G , Henriques S F , Ribeiro C . The diet-microbiome tango: how nutrients lead the gut brain axis[J]. Current Opinion in Neurobiology, 2020, 62:122-132.
- Lendrum J , Seebach B , Klein B , et al. Induction of intestinal dysbiosis through broad-spectrum antibiotic gavage, high-fat feeding: effects on the microbiota-gut-brain axis and sleep behavior in mice[C]// National Conference of Undergraduate Research. 2016.

