抛开大力出奇迹的极端情况,固体的形状和体积确实不能轻易改变。而液体容易改变形状,但不能改变体积。气体则可以任意改变体积和形状。
简单来说,这是因为固体中的原子排列紧凑,原子的运动幅度小,原子基本上被“锁死”在固定位置。液体里的原子排列依然紧凑,但原子运动幅度大,可以四处流动。气体分子则没有具体的排列形式,可以几乎不受限制的到处运动。
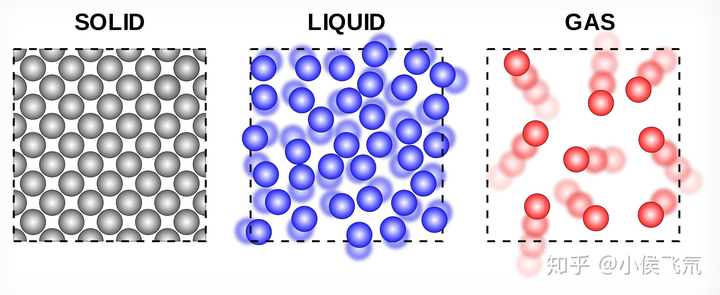
典型的原子间相互作用如下图所示,横轴是两个原子之间的距离,纵轴是能量。原子受到的力,总是指向能量降低的方向。
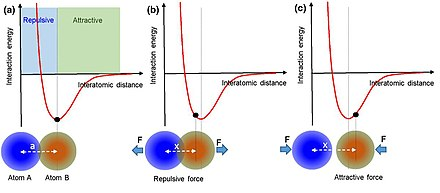
因此,当原子 A 和原子 B 靠的太近时,AB 之间互相排斥。而当 A 和 B 分开太远时,AB 之间就变成相互吸引。
这么看,AB 之间的距离应该稳定在曲线的最低点。但原子是处于不断的运动当中的,而原子运动的能量,则会让他们偏离曲线最低点。
这就好比你把一个弹珠放在锅里,然后来回晃动锅,弹珠也会在锅底附近来回晃动(说平底锅的泥奏凯)。而原子晃动的剧烈程度,从宏观上来看,就是温度。
通常情况下,能量 - 距离曲线并不对称,原子间相互靠近比较困难,分开却容易些。因此,当温度上升,原子运动的幅度增大,原子间的平均距离是增大的。
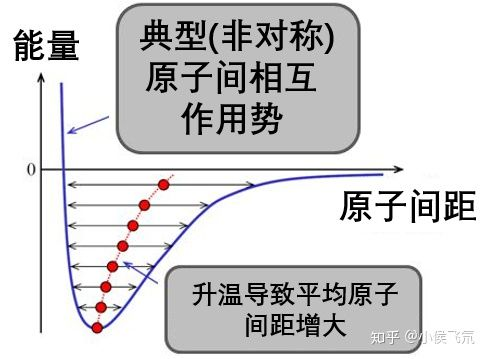
当温度低时,原子被紧紧束缚在能量最低点附近,只能做小幅度的振动,此时原子的排列是非常紧密的,例如一颗金属颗粒在原子尺度上看是这样的:

可以看到,固体中的原子都被“锁死”了。这一点体现在宏观上,就是固体不容易变形。
当温度逐渐升高,热振动开始部分的摆脱原子间的束缚,原子间的距离可以在较大的范围内波动。此时,原子不再被“锁死”在某个具体的位置,而是不规则的移动了起来。这个时候,固体就融化成了液体。
液体中的原子是可以到处流动的,但这个流动依然是有限制的,需要和周围的原子保持一定的距离,不能离得太远。宏观上看,就是液体能够变形,但不容易改变体积。

把液体继续加热,原子的运动幅度进一步增大,直到完全摆脱相互之间的束缚。这个时候液体就气化成了气体。
气体分子之间的距离通常较远,即使偶尔碰撞在一起,较大的动能也会让分子互相弹开。因此,气体分子可以几乎不受限制的移动。宏观上看,就是气体既能改变形状,也能改变体积。