如果没有考研、竞赛、考试的需要,建议题主看些新一点的原子物理科普,或者国外无机化学书,国内一些无机化学资料的历史包袱有点重了。
“xx 元素有亲氟性、亲氧性”这种说法就是炼金术时期传下来的。“硅单质有亲氟性”这个说法怕是百年前不区分元素和单质时期的说法了。
回到问题上,另一个答主也说了,现在不觉得这个体系中的 d-p 反馈π键影响很大。
硅亲氟可以从动力学和热力学两个角度解释。
动力学上 Si 和 F 反应能垒低,可以简单地理解成硅可以 6 配位。这个问题可以反过来讨论全氟烷烃的稳定性,全氟烷烃大多是热力学不稳定动力学稳定的。
下面的键能数据参考的是罗渝然《化学键能数据手册》,以前因为碳元素更常见,所以把硅当成特殊的。现在看来更多的是“第二周期特殊性”,又小又硬(解释很多,有可以搜一搜)的第二周期 p 区元素相互之前形成共价单键键能异常的小,尤其是 N、O 和 F。
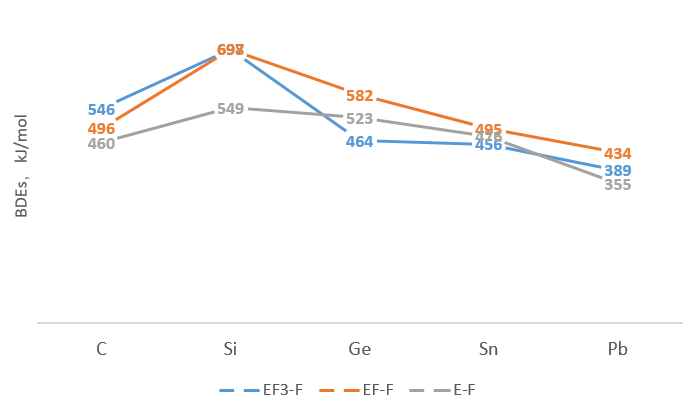
这个键能除了“d-p π键”也有用“软硬酸碱理论”解释的,后者稍微靠谱一些吧。
至于“H 这样的也有 6d 这种高能层的轨道,只不过是空着的”
这么说只是因为基态时 6d 能级等原子轨道上没有填电子,书上氢原子光谱那一节多看看。
“反馈π键”最经典的例子是羰基配合物,中心的 d 金属和配体的反键轨道相互作用。后来这个概念被扩大了,提出了 d-p(比如 Si 的空的 3d 和氟的 2p)之间的相互作用,用来解释硫酸根中的硫氧双键,一些反常的键角键角和反应性问题。比如下面这个:
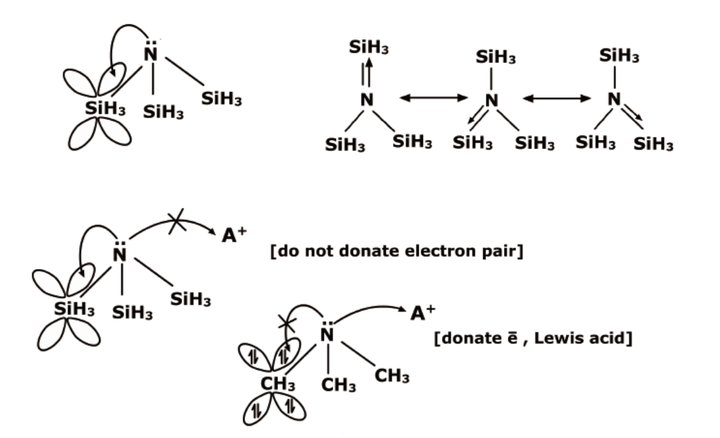
这个例子是 VSEPR 中的经典反例。
当年认为存在 d-p π键的理由是“对称性匹配”“能量相近”,后面的能量相近就可以回答题主的另一个问题——“磷不是没有 3d 能级吗?那为什么有 3d 空轨道?那是不是 H 也有?那岂不是都可以成 d-p 派键了?”
能量差太大形成不了,所以现在认为反馈π键还是主要出现在过渡金属化合物中。
Si 和 N、O、F 之间的能量相近还是不相近呢?做计算化学的很多觉得不相近,但因为太多例子都可以套“d-p π键”的解释,反馈π键这个理论一度变成了主流解释。硫酸磷酸里的双键画着画着也成了“习惯”,国内很多教材都是延用的。
那到底硅和 N、O、F 之间有没有反馈π键呢?这个问题在上世纪后半叶争论了很久,比如下面这篇 1970s 的文章,它从各种边边角角的间接实验证明存在 d-p π相互作用,那时候计算化学开始发展,质疑 d-p 反馈π键的人越来越多,所以此文开头基本上就是在说“即使理论计算和实验数据都表明 d-p π相互作用很弱,我就是要说它有”。

这种“执着”真的莫名其妙。比如前几天有人用氮气的“分子轨道混杂”来向我证明氮气是 sp 杂化的,都用分子轨道了还认为只要是发生了相互作用就叫杂化。还有认为勒夏特列原理是神圣不可侵犯的,因为符合他的哲学思想。
哎,只能说现在的理论和实验证据更多了,d-p 反馈π键如今看来确实有些“想当然”了。
这方面的资料也不少,比如:陈天阳, 范如本, 陈翔宇,等. 超价分子中的 d 轨道. 大学化学, 2016, 02(2):38-45.


