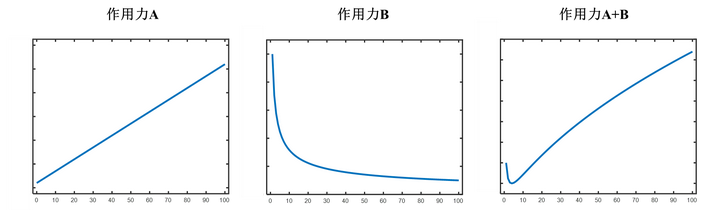
简单来说,是两种不同的作用力(氢键和热运动)对水的密度产生了相反的影响。在特定的情况下,这两种力量达到了某种平衡,使得水的密度达到了最大值(体积最小值)。比如我们假设作用力 A 所带来的影响是随着温度增加而体积增加,作用力 B 所带来的影响是随着温度增加而体积减小,那么两者叠加起来就很可能会实现体积达到一个最低点。(以下只是示意图,并不代表真实的定量关系)
如果深入探究其内在原因,我们可以说,水的反常膨胀现象是由于对称性破缺带来的影响超过了分子无序热运动的影响。换言之,当温度下降至 4℃以下时,由对称性破缺引发的结构变化开始占据主导地位,导致水在冷却时反而开始膨胀。
实际上像这样的反常膨胀也在很多其他物质中存在,比如具有特定取向作用力(directional interaction)的物质——石墨烯[1]、石墨[1],或者一些氧化物——β- 石英[2]、氧化亚铜[3]等。
在绝大多数情况下物质是热胀冷缩的,这是因为更高的温度意味着更加剧烈的分子无序热运动,从而导致分子间平均距离增大从而热胀冷缩——这一影响对于水依然存在。所以在分子热运动的作用下,相同质量水的体积会随着温度的升高而增加。

而另一方面,水分子中具有很强的氢键作用,这些氢键会使得水分子形成一些水分子簇(water cluster)——这些水分子簇有些类似于冰晶的结构了。当没有形成这类水分子簇时,水分子之间的距离比较接近;而当形成水分子簇后,由于氢键的定向性质,使得水分子之间的排列无法变得紧密,从而使得体积增大。而温度越低,水分子越容易生成氢键。换言之,当温度升高时,水中氢键的数量也就越少,那么水分子簇也就越少,从而水分子更容易紧密地排列在一起。也就是在氢键的作用下,相同质量水的体积会随着温度的升高而减少。
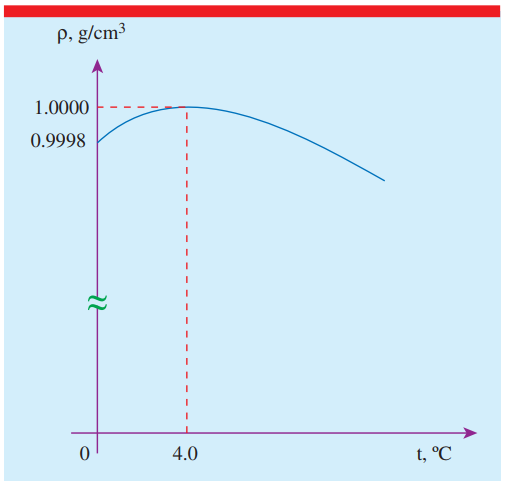
那么当这两种作用共同存在时,就会使得在某一个特殊的温度下,两种相互作用对于体积的影响达到了某种平衡,从而使得此时的体积最小(密度最大)——这个温度正是 4℃.
当温度高于 4℃时,水分子热运动占主导,此时表现出来的就是热胀冷缩;
当温度低于 4℃时,水中氢键作用占主导,此时表现出来的就是热缩冷胀。
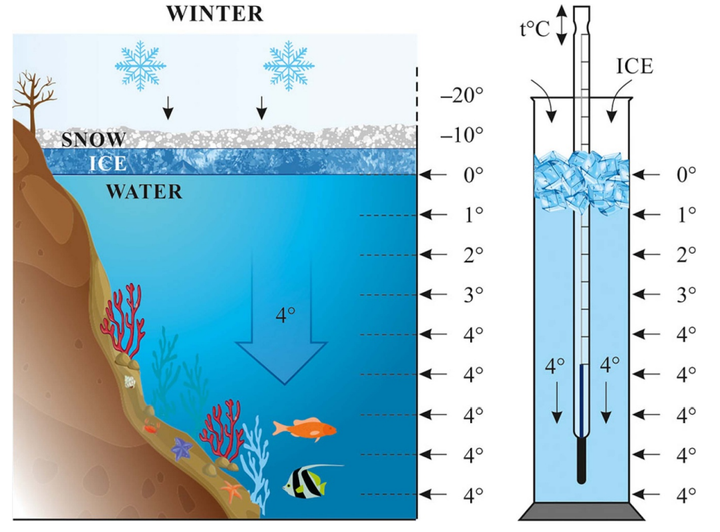
水这样的性质对于生命的延续至关重要:无论外界是什么季节,较深处的水温一直保持在 4℃,使得水生生物无论在严寒还是酷暑下都可以生存下来。[4]
下面将这个话题稍微升华一下——从水的这个例子中可以体现出对称性破缺所带来的影响。
在较高的温度下,水分子的排列是无序的,这种无序性可以在全局上看作具有 SO(3)旋转对称性——即无论你如何旋转你的观察视角,你看到的都是一样的随机、无序的分子排列。
然而当水开始冷却时,情况就发生了改变。由于氢键的形成,水分子开始排列成一种更有序的结构,这个结构类似于冰的晶格结构。在这个过程中,局部的对称性——即你在一小部分水分子中看到的对称性——开始增加。但是,由于这种有序的排列是在全局上不均匀的,因此全局的 SO(3)对称性实际上在降低。
因此,从对称性的角度来看,水的反常膨胀现象可以被理解为在冷却过程中,系统从一个全局的 SO(3)对称性(高温,无序)转变为一个具有更高局部对称性但是全局对称性降低的状态(低温,有序)。这种对称性的变化对应于水的物理性质——即其密度和体积——的变化。
实际上不少的反常膨胀例子中都可以看到像这样的对称性破缺的影子(然而并不是必要条件)。
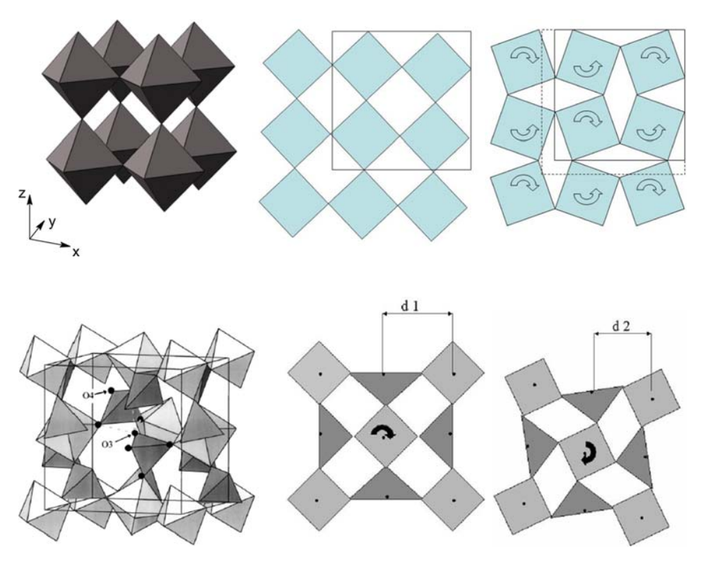
在一些具有 M-O-M 结构的氧化物中(比如石英、ZrV2O7、一些沸石等),更高的温度会使得 M-O 键变长从而使得体积增加;但是另一方面更高的温度也会使得横向振动增加,从而使得 M...M 之间的距离减小,排列更紧密体积减小。所以在特定的温度范围内也会实现热缩冷胀。[5]
比如钙钛矿或者钨酸锆等都具有这样的热缩冷胀的性质,可以看到在不同的温度下晶格结构也会具有不同的对称性。
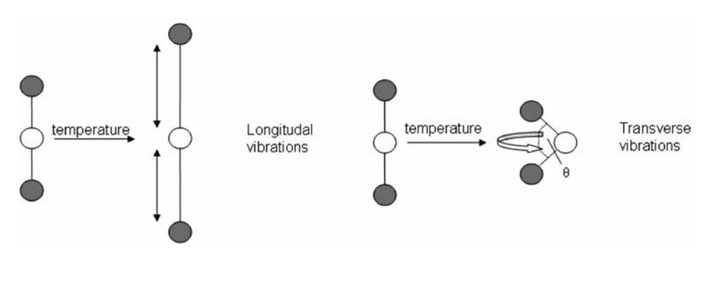
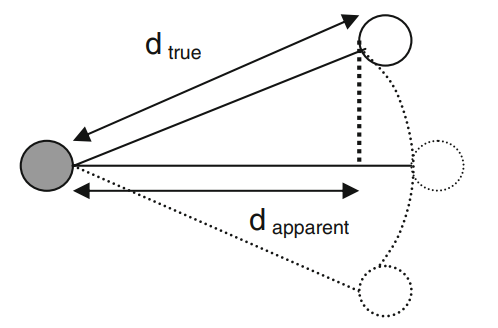
下面是另外一种不直接涉及对称性的例子。在分子中存在一种“天平动”(libration)的运动方式,就是其中的原子围绕着其平均位置的小范围振动和转动。当温度越高时,libration 程度越强烈。如果该固体是非紧密堆积的话,这样的 libration 就使得等价键长变短,从而使得体积收缩。
总结:
水在 4℃是密度最大(体积最小)主要是由于两种不同的相互作用(氢键和分子热运动)共同作用的结果;此外这其中也反映了对称性破缺。
而像这样的反常膨胀现象,实际上在不少其他的物质中都是存在的,并且具有多种不同的机理,其中一种常见的机理就是对称性破缺。

