不看公式版:
日常的三态变化,就是所谓的一阶相变。其特征就是相态转化过程中呈现出一种不连续性。与此相对应,还有更加复杂的连续相变。一般的热力学描述(如对称性破缺)并不能回答题主的问题。因为这些描述中其实首先预设了气液固三态的存在,然后再用热力学函数来分析三态变化。但是题主的问题恰恰是我们的预设前提,也就是说:
为什么会有气、液、固三种典型状态?
而不是
在已知存在气液固三态的前提下,如果解释这三态的区别?
首先这里我用平易近人的方式来说一下。
一阶相变的不连续性
其实,气态是一种最容易理解的状态。在气态下,分子距离很远,并且分子运动剧烈。因此分子间的束缚 - 分子间力相对而言就非常弱,可以忽略掉。当我们把分子间力忽略掉的时候,分子就像是一堆相互碰撞的硬球,这就是理想气体。
固态也是一个相对容易理解的状态 - 它是一种有序结构。在这种结构中,每一个分子都找到了与周边分子相互作用势能最低的位置。因而形成了最稳固的状态,这就是晶体。
液态介于其间,相对就复杂得多。简言之,就是因为分子运动足够剧烈,导致总是有些分子不安分地呆在势阱种。分子间的相互束缚总是快速地断开、连接,导致它们相互滑移。但是这些运动又不够剧烈到它们从相互作用之间逃离,变成自由分子。
三态变化中容易理解的是,从气体逐渐降温,它们会渐次经历以上三种状态。但是,不容易解释的是,当我们对气体降温,直至最后结冰,这整个过程中,出现了两次不连续的跳跃。这两次跳跃就把状态分成了三个截然不同的聚集状态。所以关键的问题是:
这种不连续性是如何产生的?在不连续跳跃的时候,为何会有两种不同的聚集状态并存?
我们用水来做例子说明这个情况。我们想象有一个系统,是一箱水蒸气。现在我们开始向外抽取热量。随着热量的向外传递,蒸汽的温度不断降低,体积不断缩小。达到沸点的时候,温度则不再降低,这时候液态水就形成了。此时两种聚集状态同时出现,中间有明显界面。
也就是说,这是一种不连续的变化:水蒸气并不是一直连续降温,体积一直连续缩小的。它会在某个温度(沸点)突然发生了阶跃式的变化:体积突然大幅收缩,热力学性质突然发生跳变。而这种变化就对应着液态水的生成。这种突发的不连续性,就把水的状态分割成气液两态了。
同理,当我们继续降温,就会又出现一个不连续的变化。这个不连续性,就把水的状态分割成液固两态了。
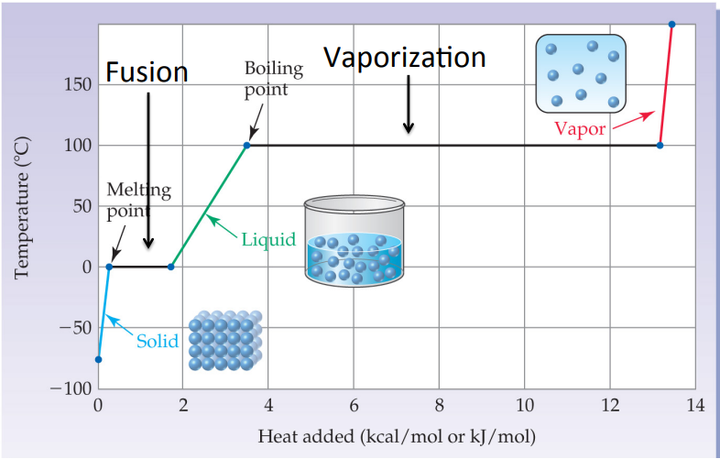
我们不妨来开一下脑洞:我们来假想一下,如果在降温过程中,蒸汽可以连续地变成水,然后连续地变成冰。也就是说,随着降温,蒸汽体积不断缩小,密度不断增加,然后渐渐地变成了水(不存在两相并存的过程)。然后随着持续降温,水渐渐地粘稠,变成果冻状态,然后果冻渐渐变硬,最终变成冰。
在这种假想的情况下,我们会觉得水只有一种相态。他只不过是密度和“硬度”的连续变化而已。
现在,正是因为在过程中出现了两次不连续过渡,才让我们产生了“气液固是截然分立的相态”这种概念。
相的稳定性
那么,为何会有这种不连续变化呢?这是热力学失稳结果。也就是说,当蒸汽降温、收缩的过程中,会在特定的时候进入到一种不稳定的过渡状态中,这种过渡状态无法稳定存在,会自发崩解为两个稳定的相态。
我们这里先说一下关于热力学稳定性的结论:
一个热力学状态的稳定性条件是,它的比热必须大于零,或者说它的膨胀率必须大于零。
这里稍加说明。为何有这种条件。有兴趣的话,可以看后面严格的热力学推导。
比如说,如果一个系统的比热小于零。那么会发生什么呢?
如果系统比热小于零,意味着当它向外散失热量时,它的温度上升,反之如果它吸收热量,则温度下降。我们想象一个孤立系统,它无时无刻面临着内部的涨落 - 当然,这些涨落的波动非常小。在一个小局部,突然产生了一个小的波动,使得它的产生了一点向外的净能量流动。那么:
- 由于负比热的存在,导致它的温度上升。而同时,它的周边会接收到传入的热量,因而同样道理导致周边的温度下降。
- 这样一来,就会形成一个温差。
- 这种温差会加速这个局部向外的热量流动。
- 因此,这会进一步导致该局部的温升和周边的温降,进而加大温差。
- 从而加剧热量传递……。
这就形成了一个正反馈。导致系统平衡的崩溃。这个局部的温度迅速上升,而周边则温度迅速下降。
同理,如果一个系统的膨胀率小于零,那么会发生什么呢?
一个负的膨胀率意味着,当系统的压力增加的时候,它的体积将会膨胀;压力减小的时候,体积缩小。那么,当系统中产生一个小波动,那么:
- 局部压力增加,体积膨胀。
- 体积膨胀导致其压缩周边的体积,周边体积缩小,因此压力缩小。
- 这样一来,该局部压力增加,周边压力降低,就形成了压力不平衡。
- 这种压力不平衡导致这个局部继续膨胀,压力继续增加。
- 因而周边体积继续缩小,压力继续降低。
- 因此,压力不平衡加剧。
- ……
这就形成了一个正反馈。导致系统平衡的崩溃。这个局部的压力迅速上升,而周边则压力迅速下降。
气液相变
那么,这种稳定性条件又和相态变化有何关系呢?
答案是,从气态到液态的变化过程中,中间的过渡状态是不稳定的。因此气体会直接跳过这种过渡状态变成液体。
从气体向液体过渡的过程中,理论上的确存在一个连续的过渡状态。但是,这种过渡状态有负热容或负膨胀率。
这个负热容是怎么来的呢?我们可以从分子间力说起。分子间力是一种短程力,它随着距离迅速衰减,只有当分子十分靠近的时候,才会发生作用。
气体状态下分子间力可以忽略,但是当分子间距离足够接近、且运动比较温和的时候(温度较低时),它们之间的吸引力就不可忽略了。而负热容和负膨胀率的性质就是由分子间力引起的。
我们先来看看这里的负膨胀率是如何起作用的。具体讲,在此时,如果系统的局部发生一个波动,导致该处分子间隙变小,会发生什么呢?很显然,
- 局部分子间隙的变小导致该局部的分子间吸引力增加,
- 吸引力增加导致它们更加靠近,
- 更加靠近则导致吸引力更进一步增加,
- 形成一个正反馈,从而使得分子们迅速聚集起来,形成液态。
而同时,该局部的周边会发生反向的正反馈:
- 该局部分子的聚集导致周边分子间隙增加,
- 因此周边分子间吸引力减小。
- 分子间吸引力减小会使得分子更加自由,分子间力进一步减小
- 迅速膨胀,形成气态。
这就是负膨胀率的影响。
我们也可以换一个角度,从负热容的角度来说这件事。当系统向外放热的时候,体积缩小。由于分子引力的作用,导致它的势能下降。势能的下降就会使得分子动能上升。因此它的温度反而上升。温度上升导致它放热更快,这也是一个正反馈。我们前面看到,这是一种不稳定的状态。因此,这种过渡状态无法存在,它会迅速崩解为稳定的液态和气态,成为两相并存的状态。这就是负热容的影响。
也就是说,当分子间吸引力开始起作用的时候,理想气体的那种自由分子的状态就被打破了,它变得不稳定,要么倒向气态,要么倒向液态,而不可能稳定地存在于气液的过渡态。因此,只有两相并存的状态,而没有两相过渡的状态(特殊情况下会存在,但是极不稳定)。
这个过程和黑洞的形成原理其实是类似的。在自引力系统中,一个系统的熵最大状态不是均匀分布的状态。这就是为何星云会聚集变成恒星。分子间力显然和万有引力完全不同,这种不同体现在分子间力是一种短程力。比如说典型的 London 力是距离的六次方反比的。因而普通的均匀气体是一种稳定的状态 - 当分子间距离足够远,分子间力几乎为零。而自引力系统中,万有引力是距离的平方反比的,所以万有引力是一种长程力,因而星云就会收缩。
只有当气体体积足够小,小到分子间力不再可以忽略时,此时分子间力才成了系统不稳定的源泉。
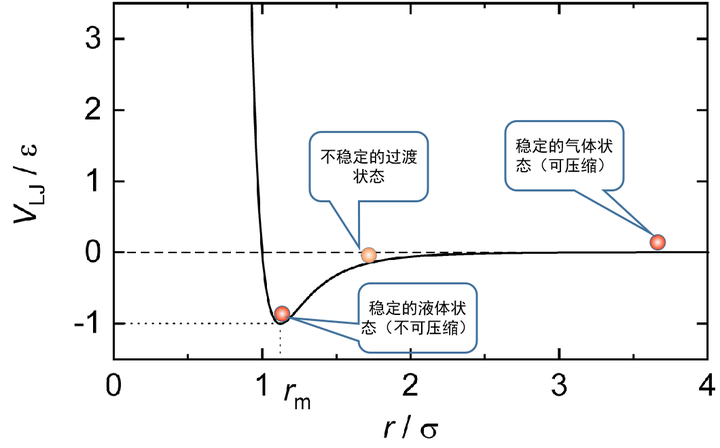
但是,气液两相之间的转换,并不一定会发生这种失稳现象,也就不一定会出现不连续的跃变。在超临界状态下,这种变化就是连续的(这就是下文小刚老师的答案中所说的气液是一相的原因。这个说法不能说错,但是太潦草了,对没有接触过相变理论的人非常容易误导)。在超临界的情况下,由于温度和压力都很高,分子间的碰撞就会一直占据主导作用,而分子间的吸引力就不再重要,因此绕过临界点从气体过渡到液态是没有不稳定的过渡态出现的,因此也就没有相变过程。
液相的稳定存在
上述不稳定的气液过渡的状态中,由于分子间吸引力的存在导致分子聚集状态直接决定了势能的变化,导致了负热容 / 负膨胀率的产生。那么,势能最低的状态是什么呢?显然,是晶体结构。从气体的自由分子,到分子开始聚集,再到最终晶体的形成之间,就会一直伴随着分子势能的下降。直至最稳定的晶体结构。这就出现了一个问题:
分子的聚集态在气体和液态之间,为何会出现一个稳定的液相(在液相中分子势能不变),而不是从气态直接过渡到固态呢?
一言简化之,就是液态和固态之间的对称性是不同的。但是这个情况会比较复杂。
从液态到固态的变化,其密度不会发生显著变化。也就是说,分子间距的变化很有限。但是一个最大的变化就是,从分子间相对自由的流动变成了长程的稳固有序排列。从宏观上说,就是固体的剪切模量不再是零。F. A. Lindemann 上世纪初的模型中,假定分子的振动幅度达到分子间距的一定比例时,固体的稳定性就失去了,因此它就开始融化。融化所吸收的热量于是就保持了固态中的分子振动不会继续增大。这个模型很简单,也很有用。但是它并没有回答这样一个问题:
液相到底是一种什么样的稳定状态呢?
固态是一个相对容易理解的状态 - 它是一种有序结构,势能最低的状态。在这种状态下,分子间相互作用力最强,分子的位置就被稳固地束缚起来。但是液态是一种分子间力相对较强,但是有不足以使其形成稳固排列的状态,情况就非常复杂。可以说直至现在为止,令人满意的普适理论还没有出现。因为这个过程中太复杂了,这和具体的分子构型、分子间相互作用的形式、晶形结构、内部缺陷、表面性质等一系列复杂问题都息息相关。从液态到固态的变化,单纯从单个的分子间的相互作用是不容易解释的,必须要从大量分子的长程结构入手 - 因为固体和液体的最大区别就在于长程的有序结构。
气液态的区别情况可以简单地用下图表示[1]
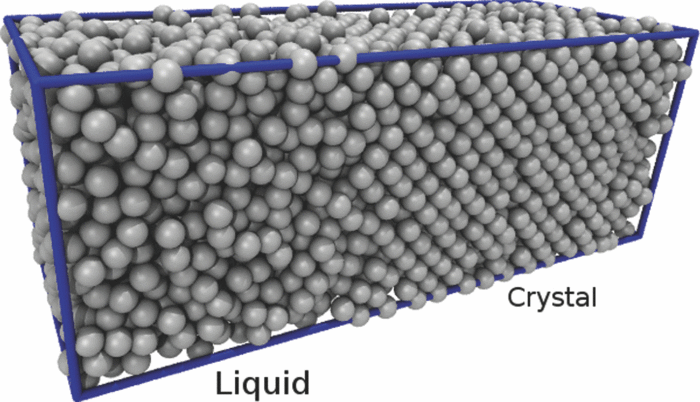
因此,固相的形成不是单一的分子之间的相互作用,而是大量分子的协同作用,在这个过程中,某个局部的热运动涨落就可以轻易地把周边的有序结构给打破了,而这种局部有序结构的丧失就会像多米诺骨牌一样引发全局的崩溃。这就使得固相的形成难度比液相更高 - 它需要把热运动的影响降低到更低的水准。
还是以水为例,像水这种分子极性高并且相互作用复杂的物质,聚集形态会非常复杂。水中的氢键存在非常普遍,而氢键的形成与分子的形状、位置、取向息息相关。当每个分子都以最多氢键的方式和其他分子结合时,水分子以规则的方式排列,这就是晶体 - 冰。因为氢键的强度远高于一般的分子间力,这种方式的排列,就是势能最低的情况。
但是在温度比较高的时候,这种规则排列无法达成,因为水分子不断振动,打破这些氢键。水分子间的氢键就一直在不断地打破并且不断地重建过程中,这个过程是以飞秒计的。有人说,整体看来在液态水中,大约有 12%的氢键处于被打破的状态[2]。就是因为这 12%的氢键断裂,使得水的整体规整结构被破坏了。长程的聚集难以持续,但是短程的聚集却是很容易的。在液体中,分子间的复杂相互起作用,使得分子会三三两两地聚集成团,不断发生“滑移”。由于分子的不断碰撞,这些分子团会呈现出聚集 - 打散 - 重新聚集的过程。于是乎形成了流动的状态。[3]
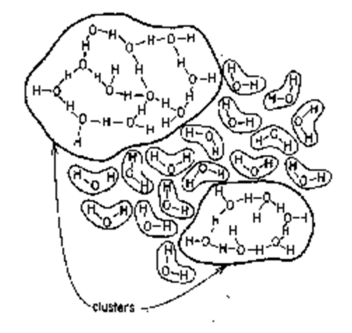
一般说来,液态水中的水分子大约聚集数量在 20~200 个之间[4]。这种局部结构,有规整的,和冰的晶型结构类似,也有不规则的。从某种程度上说,水中的结构在很大程度上和冰没有本质区别,所差的,只是能否形成长程结构
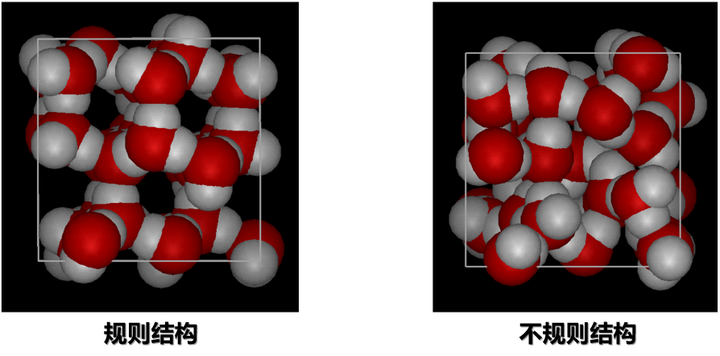
比如说,一种推测的规整分子团的结构是 280 个水分子的聚集[5]。
所以说,人们对固液相变的理解,并不像气液相变那么清楚。这里我仍然定性地用描述一下我的个人理解。
前面提到,分子间相互作用是一种短程力。当在液体中,很多分子聚集成团的时候,分子团的尺寸就会比单个分子大得多。相对而言,分子间力就更不容易发生作用。直观讲,较大的分子团接近的时候,其接触点相比于单个分子要小得多。比如说像上面的水分子团的结构,一个
的分子团所能提供的氢键点位要远少于 280 个单个的水分子。因此,一旦分子聚集成团,那么分子间力的影响就显著下降。
我们前面提到,分子间的相互作用力在气液相变过程中起到了关键作用。它的存在导致气体向液态过渡的过程中出现了状态失稳的现象,从而导致了不连续的变化(相变)。而在达到液态的时候,由于分子间作用力的影响,分子局部聚集,从而导致分子间作用力的影响力下降,就导致了它不再继续聚集,而保持了一段时间的连续变化,这就是稳定的液相的存在。
液固相变
对液态水来说,随着温度的继续降低,分子间作用力的影响又会缓步增加。随着分子间力的影响增加,分子团之间就会越来越出现互相吸引从而更加聚集的情况。此时,类似前述气液相变中的不稳定过渡态就又会出现了。
比如说在某个局部,因为一个扰动,分子的聚集程度突然增加了,那么:
- 分子间的聚集增加,因此中间的自由分子或者自由小分子团就会因为这种聚集而导致空间的“拥挤”从而运动更加不自由。
- 这些被“挤住”的分子更加不自由,就更加容易“加入”到这些大规模的聚集中,形成较大尺度的结构。
- 而这种更大规模的聚集就导致了更多的自由分子失去了自由移动的空间,进而促使更大尺度的有序结构。
- 因此在这种正反馈作用影响下,介观熵的有序结构就在这个局部中出现 - 固体的晶核出现了。
- 如果这个晶核足够大,表面能足够低,就可以跨过能垒,形成宏观上的有序结构,成为生长的固相。
而相反地,这个局部的大规模聚集就必然导致周边分子聚集程度被打破,同时,由于上述的大规模聚集导致的势能下降,必然使得周边分子运动更加剧烈。那么在周边:
- 分子间的聚集被打散,中间的自由分子或者自由小分子团就会因此导致空间的“宽敞”从而运动更加自由。
- 这些更加自由的分子就更加容易“冲破”大规模的聚集,打破大尺度的结构。
- 而大规模结构的打破就导致了更多的自由分子的产生,促使更大尺度的有序结构进一步打破。
- 因此在周边就形成了稳定的液态。
我们可以看到,前述的大尺度有序结构的形成伴随着势能的下降。这就类似气液过渡态的那种负热容的情况:当向外传递热量的时候,长程的有序结构形成,从而导致势能显著降低。而势能的降低则会导致动能的增加,使得温度增加。于是这种过渡态就会崩解为稳定的固态和液态。形成两相并存的不连续过程。
请注意这是一个非常定性地、简化地说法。这中间表面性质以及缺陷的性质起到了极其重要的作用,但是这里就忽略了。
空间熵和动量熵
从热力学第二定律的角度,液态结冰的过程可以这样来看,这是一个是以空间熵换取动量熵的过程。
我们可以简单地将熵归结为相空间的体积的对数。也就是说,一个系统的熵,取决于两个方面:它在位置空间中的自由度,以及在动量空间中的自由度。
很显然,液态在位置空间中的自由度要大于固态。因为液态分子虽然受到束缚,还是可以在较大的空间中移动,而不是只在晶格附近振动。所以说液态有着较高的熵。
随着温度的降低,分子的热运动降低,它的动量空间自由度就会随之下降。也就是说,它的运动的速度分布变窄了。
固态有着更低的势能,可以换来更高的动能,进而得到更大的动量自由度。而同时它却有着更低的位置自由的。总的熵就受到这两种相反趋势的支配。当温度较高的时候,系统选择更大的位置自由度,从而达成更高的总熵。而当温度较低的时候,分子已经非常拥挤了,此时位置自由度的贡献降低,而动量自由度的贡献相对更高。达到一定的低温后,一部分分子就会自发放弃位置自由度,选择更加规则的空间排布,释放出能量来保持另一部分的温度不再持续下降,从而使得动量自由度维持在较高的水平,换得更高的总熵。从宏观上看,就表现为一部分液体结冰,从而维持系统的温度不再下降。在这个过程中,熵减是由位置自由度的压缩完成的。
假使在降温的时候液体不结冰,那么温度会持续降低,那么系统的动量自由度会持续下降 - 因而它对总熵的贡献持续下降。而此时由于分子相对已经很拥挤了,所以位置自由度也不会很高。宏观上,这就是一种上面脑洞中提到的“果冻”类似的过渡态。这种过渡态比起两相并存(即牺牲位置自由度换来动量自由度)的熵更低,所以它会自发地变为两相并存。
如果你对朗道相变理论很熟悉,这种情况就是相变过程中的鞍点情形。从自由能上看,就是随着系统有序度(coorelation length)的变化,存在两个稳定态和一个亚稳态。
这种情况可以用一个日常生活的例子来说明。比如说我们有一个正方形的盒子,里面放置着几根牙签。我们晃动盒子,会发现牙签的排列非常杂乱。这是一种典型的熵增。但是当我们放置一把牙签进去,然后再晃动盒子,我们会发现原来杂乱的牙签会整齐地排列起来。这看起来变得更加有序了。这是自发熵减了吗?不是的,因为牙签的整齐排列,会使得牙签的运动更加自由。所以它的取向虽然更有序了,却换来了运动的更大杂乱。
综上所述,三个典型相态的形成就是这样的:
补充公式版:相变的一般热力学描述
从热力学上讲,自由能最低的状态是最稳定的存在状态。从吉布斯方程看:
在等压过程种,由于熵总是正值,所以自由能总是随着温度的增加而减小。并且,由于
所以定性看,气液固的自由能随温度的变化如下:
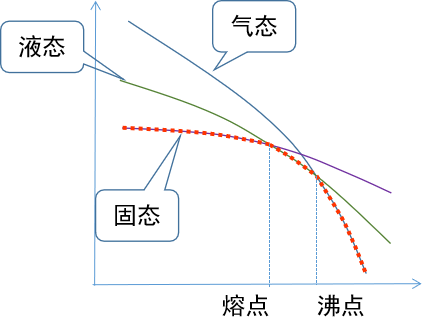
因此随着温度的降低,物态就会从气态变成液态再变成固态。当气液自由能相等的时候,就是沸点,液固自由能相等的时候,就是熔点。
由于
所以,由于两个相态之间的熵值不连续,则必然会出现相变过程中的不连续,表现为潜热的存在、密度的变化等。
补充公式 2:典型的稳定性判据
这里我们推导一下相态的稳定性判据。
对一个孤立系统,在一个平衡态,我们有:
这个平衡态必须有两个特征,第一,它的熵最大,第二,它是稳定的。
熵最大这个很容易理解,因为这是热力学第二定律的直接结论。它是稳定的,意味着对任何扰动,它是负反馈的,也就是说,它会自发地返回到平衡态。
我们假设一个系统。这个系统中一个局部发生了一点点扰动(比如说温度变化了一个
),那么这点扰动会引起系统如何变化呢?
我们把这个系统分成两个子系统:发生扰动的那个小局部为子系统 1,剩余的为子系统 2。那么我们有:
对于这个扰动,我们可以计算它带来的熵变:
由热力学基本公式我们知道
所以:
请注意,上式中用到了孤立系统能量守恒的条件,也就是:
由于
为无穷小量,所以上式中第一项为零。而对于第二项中,我们有:
所以,第二项就变成了:
由于子系统 1 远远小于子系统 2,所以,
由于平衡态中熵处于最大值,所以,任何的扰动都只能使得熵减少。因而,我们有:
因此,我们得到了相态稳定的条件,就是它的比热必须大于零。
同理,我们可以假设一个压力的扰动,这样我们会得到另外一个条件:
也就是说,相态稳定的另一个条件就是,它的压缩率必须大于零。