是氧合而不是氧化。即
提到 的 不是「化合」,而是「配合」。
每个 Hb(血红蛋白)分子由 1 个珠蛋白和 4 个血红素,对血红蛋白的整体结构就不做搬运了,其中运输氧的关键是血红素又称亚铁原卟啉,是下面这个大萌物。
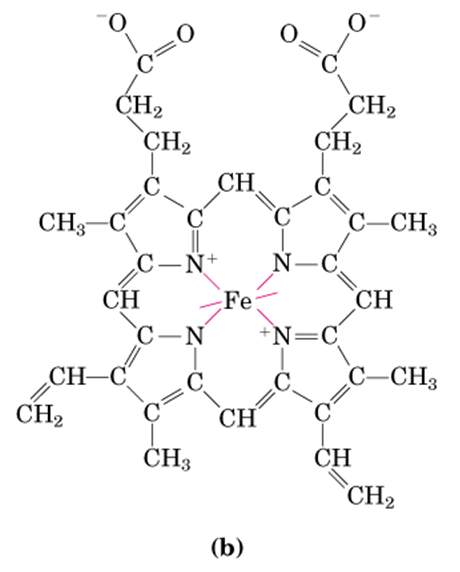
如图,根据原子轨道理论,二价铁会形成六个配位键,其中四个被上图卟啉环中的吡咯基上的 氮(N) 占着,还有两个,一个被组氨酸残基的氮占着,另一个用来与氧分子配位(如下)。那么血红蛋白是如何运输氧气的呢?
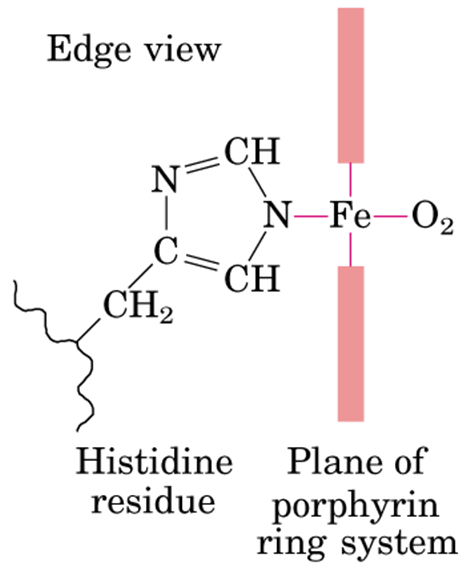
------------------- 组氨酸残基 ---------------------------------- 图(b)中的卟啉环 ----------------- 氧气
(连接着多肽链曲折缠绕形成亚基)
该构造厉害之处在于卟啉环的孔径大小正好符合二价铁离子,可以把氧分子卡住,而此时辅以结合力相对较弱的配位键简直要吊炸天!首先因为配位键结合力度较弱,所以解离和结合的难度相对就小,当二价铁与氧气配合后,氧的另一端由于可以形成氢键会对 Hb 的四级结构形成影响(四级结构就是多肽链亚基通过 非共价键 而形成大分子体系),因为是非共价键结合,当血液环境中 CO2 和 H+ 的浓度发生改变时,也会对 Hb 的四级结构产生影响。四级结构发生改变带来的的一个影响是 未配位的二价铁离子与氧气的的接触机会发生改变,即 Hb 再结合氧气的难度改变,产生协同效应,氧气逐个脱离,逐个增加;另一方面 (高潮来了):当血红蛋白需要脱去氧气时,四级结构的改变牵拉组氨酸残基,然后牵拉带动二价铁,而铁与氮配位能力要大于氧的,而此时氧气确无法穿过卟啉环,便被卡了下来,如此氧气便脱去。
试着想象上图从右向左拽的动态过程。
而换成一氧化碳就悲剧了。一氧化碳与二价铁离子的结合能力要比氮,氧强太多,其中其极性是一大因素,一旦结合很难脱去。影响了上述过程。
另外,从血红蛋白一级结构(氨基酸残基的排列)特点来看,大部分氨基酸是可变的,在 Hb 内部的氨基酸变异非常大,但一般都是从一种疏水氨基酸变为另一种疏水氨基酸。这样为血红素提供一个疏水的微环境,可以防止 Fe2+ 与水接触氧化为 Fe3+ 而丧失与氧结合的功能。

